中国病毒学论坛|我们一直在坚持!
标题: 年终盘点:2016中国学者领跑全球寨卡病毒研究 [打印本页]
作者: cao1976 时间: 2016-12-18 22:44
标题: 年终盘点:2016中国学者领跑全球寨卡病毒研究
Tony 病毒学界

自20世纪70年代以来,全球几乎每年都有一种及一种以上新发生的突发急性传染病出现,随着全球一体化进程的加快,突发急性传染病对人类健康安全和社会经济发展构成的威胁不断增大。2003年“非典”疫情导致我国5327人发病,死亡349人,经济损失占当年GDP的0.8%。截至2016年6月30日,人感染H7N9禽流感已导致我国770人发病,315人死亡。境外突发急性传染病输入我国的风险也在不断增加。近年来,我国境内先后发生中东呼吸综合征、黄热病、寨卡病毒病、脊髓灰质炎等多起输入性疫情。“非典”后,我国建立了一套系统的新发传染病应对策略,在一次次突发传染病事件中,逐步建立了我国传染病防控体系,并取得了多项重要科研成果。2016年我国科学家在寨卡病毒致病机制、预防及治疗领域取得了一系列重大成果,相关研究走在了国际前列。本期小编将今年我国科学家取得成果尝试做一总结,供大家参考。
一、多个科研单位第一时间分离寨卡病毒并完成全基因组测序
2016年2月9日国家卫计委通报我国确诊第一例输入性寨卡病毒感染病例。患者,男性,34岁,江西省赣州市赣县人,为广东省东莞市某公司工作人员,发病前有委内瑞拉旅行史。2 月 22 日晚,中国疾病预防控制中心发布消息称,与江西省疾控中心合作,该中心从我国大陆首例输入性寨卡病毒感染者血液标本中获取病毒,完成了寨卡病毒全基因组测序。同日军事医学科学院微生物流行病研究所与国家质检总局所属单位、广州市第八人民医院密切合作,成功分离出 2 株寨卡病毒,一株来源于从委内瑞拉入境广州的患者尿液标本,另一株来源于从萨摩亚入境深圳的患者血液标本。3月中科院武汉病毒所发布消息称其与深圳出入境检验检疫局合作,成功分离出1株寨卡病毒。该株病毒和解放军军事医学科学院首次分离的SZ01株寨卡病毒属于同一血清样本,都来源于从萨摩亚入境我国深圳的患者。
二、4月15日中美科学家揭示寨卡病毒的基因进化过程
中美科学家4月15日在美国《细胞宿主与寄生体》杂志上刊文指出,自1947年首次发现寨卡病毒以来,此病毒基因已经发生重大变化。这项研究有助了解为何寨卡病毒会导致新生儿小头症与其他出生缺陷。文章题目为:From Mosquitos to Humans: Genetic Evolution of Zika Virus
为了解寨卡病毒的基因进化历史,美国加利福尼亚大学洛杉矶分校、中国医学科学院和北京协和医学院的研究人员比较分析了41株寨卡病毒毒株,其中30株来自人类、10株来自蚊子、1株来自猴子。结果发现,虽然寨卡病毒是一种蚊媒病毒,但人类毒株与蚊子毒株存在很大不同。
 Evolutionary Relationships of Zika Virus
Evolutionary Relationships of Zika Virus
研究还表明,非洲系毒株与亚洲系毒株也存在显著差异。和从当前疫情中分离出的人类毒株最相似的,是1966年在马来西亚蚊子身上发现的毒株,而不是1968年的尼日利亚毒株,这说明当前的毒株可能是从亚洲系毒株进化而来。负责研究的加利福尼亚大学洛杉矶分校教授程根宏介绍,2007年太平洋岛国密克罗尼西亚与2013年法属波利尼西亚也曾暴发寨卡疫情。他们的研究显示,1966年的马来西亚毒株很可能是密克罗尼西亚毒株和法属波利尼西亚毒株的“老祖宗”。
三、2016年4月18日中科院微生物所高福院士团队解析寨卡病毒蛋白晶体结构取得重大进展
在高福(George F Gao)院士和施一(Yi Shi)副研究员的领导下,来自中国科学院微生物研究所、中科院北京生命科学研究院的研究人员通过解析寨卡病毒(Zika virus,ZIKV)NS1结构,揭示出了黄病毒属(Flavivirus)间静电表面的多样性。这一研究成果发布在4月18日的《自然结构与分子生物学》(Nature Structural & Molecular Biology)杂志上。文章题目为Zika virus NS1 structure reveals diversity of electrostatic surfaces among flaviviruses.
图1 寨卡病毒NS1与其它黄病毒NS1结构比较,揭示了不同黄病毒NS1存在不同的表面电荷分布特征
在这篇新文章中,研究人员报告称获得了寨卡病毒NS1 C端片段的晶体结构。通过与西尼罗河病毒和登革热病毒的NS1结构进行比较,揭示出了在宿主交互界面上一些保守的特征及不同的静电特点,由此表明了黄病毒属发病机制的不同模式。这些研究极大丰富了人们对寨卡病毒的认识,为应对寨卡病毒疫情及防控提供了重要的理论基础。 中国科学院微生物所博士生宋豪为文章的第一作者,施一研究员及高福院士为通讯作者。
四、2016年5月2日高福院士团队Cell Host & Microbe发表寨卡病毒囊膜蛋白以及其结合黄病毒广谱保护性抗体的结构研究
中国科学院北京生命科学研究院、微生物研究所、天津工业生物技术研究所高福院士研究组与军事医学科学院团队通力合作在寨卡病毒致病与防治研究方面取得重要进展,研究结果以“Structuresof the Zika virus envelope protein and its complex with a flavivirusbroadly-protective antibody(寨卡病毒囊膜蛋白以及其结合黄病毒广谱保护性抗体的结构研究)”为题于2016年5月2日发表在国际权威学术期刊Cell Host & Microbe 上。
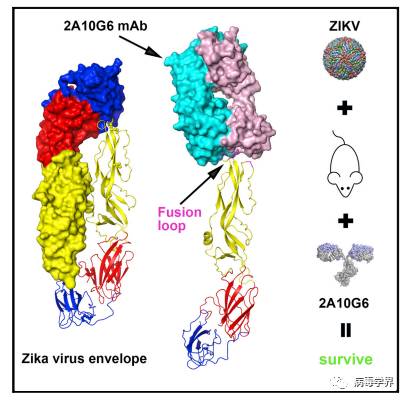
黄病毒的囊膜蛋白(E蛋白)主要负责病毒与感染宿主的受体的识别,介导病毒的入侵,因此是病毒最主要的保护性抗原。黄病毒的中和抗体一般通过靶向E蛋白从而阻止病毒的入侵,进而帮助宿主清除病毒。目前还没有针对寨卡的有效抗体的报道。 他们率先解析了高分辨率的E蛋白的三维晶体结构。研究发现寨卡的融合前E蛋白呈现二聚体构象,与黄病毒属其他成员的E蛋白的结构比较相似。但不同的是,寨卡病毒E蛋白的表面存在独有的一片正电荷区带。这一特性可能使得寨卡病毒对宿主吸附有所不同。此外,他们发现黄病毒E蛋白的融合肽区在寨卡病毒E蛋白上序列和结构都高度保守,因此选取了一种靶向到这一区域的黄病毒广谱中和保护抗体进行研究。这种称为2A10G6的抗体在他们之前的报道中能够有效的中和与寨卡病毒亲缘关系很近的其它黄病毒,包括四种血清型的登革热病毒、黄热病毒以及西尼罗热病毒。他们发现这种抗体对寨卡病毒的E蛋白具有很高的结合能力,并具有体外中和活性和小鼠的致死保护作用。进一步的抗原抗体复合物结构分析揭示出该抗体通过紧密的包裹对黄病毒入侵关键的融合肽区从而阻止病毒对宿主的入侵。
五、5月12日许执恒研究组Cell Stem Cell合作证实寨卡病毒感染直接导致小头畸形
中国科学院遗传与发育生物学研究所许执恒研究团队与军事医学科学院微生物流行病研究所秦成峰研究团队通过全力合作,首次建立了寨卡病毒小头畸形动物模型并证实寨卡病毒可以直接导致小头畸形的发生。他们在哺乳动物小鼠中发现,寨卡病毒可以在胚胎脑中快速复制,并感染神经干细胞,造成神经干细胞的增殖与分化异常,及神经元的大量死亡。最终导致大脑皮层变薄及小头畸形。通过全基因组表达谱分析,他们发现大量与免疫、小头畸形、寨卡病毒的潜在受体及细胞凋亡相关的基因出现明显异常。该研究不但提供了第一种研究寨卡病毒导致小头畸形的动物模型,还为进一步研究寨卡病毒的致病机制和相关治疗打下了良好的基础。

相关论文于5月12日在Cell Stem Cell在线发表(DOI: 10.1016/j.stem. 2016.04.017)。
六、华人学者史佩勇研究组成功克隆出寨卡病毒,有助加速疫苗研发
研究人员在《细胞宿主与寄生体》杂志上发表报告说,他们选取了2010年分离自柬埔寨的毒株进行克隆。根据其基因组序列,先把病毒基因组分成5个片段,然后分别克隆这些片段,再将克隆产物组装成一个完整的病毒基因组,接着把克隆的基因组通过分子生物学的方法导入细胞,从而获得克隆的病毒。
小鼠实验显示,克隆病毒可以导致小鼠患病,它们会出现一些神经系统疾病的症状,这跟寨卡病毒可以引起人类的神经系统疾病类似。研究人员还做了克隆病毒的蚊子传播实验。结果显示,克隆病毒有着类似于母系病毒的传播效率。研究人员表示,克隆寨卡病毒有助于对其有更加深入的了解,比如可以对任意位点、任意蛋白进行突变,从而了解寨卡病毒的致病机理以及哪些蛋白对于致病发挥重要作用。
七、中国科学院微生物研究所施一研究员和高福院士团队发表寨卡病毒NS1全长结构揭示NS1膜结合的关键区域
中国科学院微生物研究所施一研究员和高福院士团队在揭示寨卡病毒致病机制方面又取得重要进展,研究结果以“Contribution of intertwined loop to membrane association revealed by Zika virus full-length NS1 structure(寨卡病毒NS1全长结构揭示NS1膜结合的关键区域)”为题近期发表在国际权威学术期刊The EMBO Journal上。
 图注:寨卡病毒NS1膜结合示意图
图注:寨卡病毒NS1膜结合示意图
他们解析了寨卡病毒NS1全长蛋白的晶体结构。NS1存在结构不同的两个面,内表面和外表面,分别面对病毒的复制系统和宿主的免疫系统,以此实现蛋白的两个主要功能。研究人员在寨卡病毒NS1结构的内表面发现有一个长的缠绕loop可以形成疏水的“spike”,可以插入细胞膜中,参与膜结合。进一步分析发现,在不同的黄病毒中“spike”氨基酸虽然是不一样的,但是存在类似的特征,即都为疏水或正电荷氨基酸,有利于结合脂类双分子层。此外,与已有的西尼罗病毒及登革病毒NS1结构相比,发现寨卡病毒的NS1在内表面和外表面都存在不同的电荷分布特征。这项研究能够帮助人们进一步了解寨卡病毒NS1蛋白的作用机制及其对疾病的影响。
八、天津大学杨海涛教授和南京大学籍晓云教授领导的科研团队在揭示寨卡病毒关键药物靶点方面取得重要突破
2016年10月18日,国际学术权威刊物自然出版集团旗下子刊《Cell Research》杂志在线发表了天津大学杨海涛教授和南京大学籍晓云教授领导的科研团队在揭示寨卡病毒关键药物靶点方面再次取得重要突破。研究团队解析了寨卡病毒NS2B-NS3pro蛋白酶复合物原子分辨率水平的三维结构。该蛋白酶复合物在寨卡病毒整个生活周期中起关键调节作用,这一蛋白酶复合物结构的解析为开发治疗寨卡病毒的特效药物奠定了重要的结构基础。杨海涛教授课题组博士生陈霞为论文第一作者,籍晓云教授和杨海涛教授作为共同通讯作者。
研究发现,寨卡病毒的NS2B-NS3pro蛋白酶复合物在病毒的整个生活周期中起关键调节作用,只有该蛋白酶复合物被激活,并完成一系列水解反应后,病毒才能启动复制过程。因此,寨卡病毒的NS2B-NS3pro蛋白酶复合物也成为一个关键抗病毒药物靶标。南京大学和天津大学的科研人员成功解析了寨卡病毒NS2B-NS3pro蛋白酶复合物的晶体结构,揭示了病毒蛋白酶被激活的关键分子机制。利用该蛋白酶复合物作为药物靶点,科学家们已经成功筛选到一种被称为“aprotinin”的有效抑制剂。“aprotinin”是一种临床药物,并在手术中被用于止血;该抑制剂的发现将有助于进一步开发抗寨卡病毒的药物。同时,研究还发现寨卡病毒蛋白酶存在一种特殊的“自抑制”状态。因此,科学家们提出了一种全新的抗病毒药物设计策略——如果能设计一种化合物可以将病毒蛋白酶锁定在“自抑制状态”,将会导致该酶无法被激活,最终达到抑制病毒复制的目的。
九、许执恒研究组在小鼠中证实孕期感染寨卡病毒有望治愈
许执恒研究团队与多个单位(包括军科院秦成峰团队)通力合作进行了药物筛选和相关研究,最终许执恒研究组发现含有高滴度中和性抗体的寨卡病人康复期血清,可防治病毒感染胎儿的大脑,预防小头畸形症的发生。通过颅内注射的方法让胎鼠大脑感染寨卡病毒,并在感染后注射病人康复期血清。许执恒研究组发现,康复期血清中的中和性抗体在体外能够有效抑制寨卡病毒的复制;在体内能通过胎盘及血脑屏障,非常明显地减少胎儿大脑中的病毒数量,保护胎儿。因此,在小鼠模型上的研究表明,孕期感染寨卡病毒有望治愈。该研究为寨卡病毒感染的治疗提供了极为重要的线索。

该研究结果于12月6日发表在Cell Research (doi: 10.1038/cr.2016.144) 上,许执恒研究组的博士后王硕和研究生洪帅为本文的共同第一作者。该研究得到了基金委重点研究项目和中国科技部重大计划项目的支持。
十、高福院士团队与中国农业大学李向东团队合作在《Cell》发表文章揭示寨卡病毒感染与睾丸损伤的相关性
2016年11月22日,国际权威学术刊物《Cell》杂志在线发表了中国科学院微生物研究所高福院士与中国农业大学李向东教授合作的寨卡病毒最新研究成果。论文标题为 “Zika Virus Causes Testis Damage and Leads to Male Infertility in Mice”,文章发现寨卡病毒在小鼠模型中引起睾丸损伤并最终导致雄性不育,从全新的角度揭示了寨卡病毒对人类健康可能存在的影响。中国农业大学马文强、中国科学院微生物研究所李世华、中国农业大学马槊乾和贾力娜为文章的共同第一作者。
目前对寨卡病毒的关注主要集中在其引起的新生儿小头症和格林-巴利综合征等神经系统疾病。高福院士团队与李向东教授课题组的最新研究成果表明,寨卡病毒还可以影响雄性生殖系统,提示了其对男性健康的潜在危害。在小鼠模型中,寨卡病毒感染可以突破血睾屏障,在感染后第8天引起睾丸间质充血、急性睾丸炎和附睾炎,睾丸和附睾组织明显萎缩,睾酮水平显著降低。感染后第16天,大量精细胞死亡、睾丸精管断裂;第30天睾丸持续缩小,曲细精管进一步丧失正常结构;第60天则睾丸完全萎缩,内部结构被完全破坏。
进一步的研究发现,寨卡病毒虽然可以感染睾丸和附睾,却不感染前列腺和精囊腺。睾丸组织中的支持细胞(Sertoli),间质细胞(Leydig cell)和附睾上皮细胞(epididymal epithelial cells)在寨卡病毒感染后产生大量的促炎症细胞因子和趋化因子,而管周肌样细胞(Peritubular cell)和精原细胞(Spermatogonia)产生的细胞因子相对不足,这暗示了管周肌样细胞和精原细胞对寨卡病毒更加易感,可能作为病毒的贮存库。
十一、中国科技大学金腾川团队揭示寨卡病毒NS3解旋酶分子机制由金属离子间接激活
中国科学技术大学生命科学学院金腾川课题组利用X晶体衍射技术,首次清晰捕捉到寨卡病毒解旋酶只结合三磷酸核苷(NTP)、与NTP-金属离子结合后的激活初始态及NTP水解后的状态,成功揭示了金属离子激活寨卡病毒NS3解旋酶的分子机制。研究成果以“Molecular Mechanism of Divalent-Metal-Induced Activation of NS3 Helicase and Insights into Zika Virus Inhibitor Design”为题,于10月19日在线发表于《Nucleic Acids Research》杂志。

寨卡NS3解旋酶在病毒复制过程对RNA的解旋、复制起重要作用,而腺苷和金属离子是解旋酶执行功能所必须的组分。该项研究的发现,很好地解释了国外专家在其他病毒研究中发现的奇特现象,只有NTP不仅不能推动病毒解旋酶的工作,反而抑制了其活性。因此该工作揭示的这个机制,不只局限于寨卡病毒解旋酶,还适用于其它黄热病毒家族。该项研究首次为金属离子-NTP对NS3解旋酶激活的变构调节提供了结构证据,为治疗寨卡病毒感染的药物设计提供了精细的结构信息。
十二、邵逸夫医院研究人员徐妙NatureMedicine发现寨卡病毒新疗法
8月29日,徐妙和美国科学家们的研究成果“identification ofsmall-molecule inhibitors of Zika virus infection and induced neural cell deathvia a drug repurposing screen”(抗寨卡病毒感染及治疗其引起的神经细胞坏死的小分子药物的研究)以论著的形式在《NatureMedicine》上成功发表
研究者们应用高通量筛选(HTS)方法, 在用iPS细胞诱导的神经干细胞(NPC)、星形胶质细胞(astrocyte)和星形细胞瘤(astrocytoma)三种细胞上夜以继日地反复试验。功夫不负有心人,历时三个多月,研究者们终于在6000多种备选药物库里找到了三类有效药物:Emricasan可以有效保护脑神经细胞免受寨卡病毒的损伤,Niclosamide和CDK抑制剂(如PHA-690509)可以有效抑制病毒的复制,而且相互间有协同抗病毒作用。同时他们对非洲型、亚洲型的和波多黎各型的寨卡病毒均有效。
十三、严景华研究员课题组、高福院士团队研发获得寨卡病毒人源治疗性抗体
中国科学院微生物研究所微生物生理与代谢工程重点实验室严景华研究员与病原微生物与免疫学重点实验室高福院士合作,在研发寨卡病毒治疗性抗体方面取得重要进展,率先找到高效、特异性人源寨卡病毒(zika virus, ZIKV)治疗性抗体及其机制,该抗体在小鼠模型上能有效治疗ZIKV感染,有望成为治疗其感染的候选药物。该成果于2016年12月14日在国际权威学术刊物《Science Translational Medicine》发表题为 “Molecular determinants of human neutralizing antibodies isolated from a Zika patient”学术论文。严景华课题组副研究员王奇慧,硕士研究生杨化冰,江西CDC刘晓青博士以及高福院士团队戴连攀博士共享文章第一作者。
ZIKV表面含有E蛋白(Envelope),含有三个不同的结构域(DI, DII和DIII)是负责受体识别与膜融合的重要蛋白,含有产生中和抗体的重要表位。研究团队从一例南美输入病例入手,采集其康复后的血液并分离PBMCs,然后以ZIKV E蛋白为诱饵从PBMCs中分选到33个结合E蛋白的记忆性B细胞,并且鉴定出其中14个B细胞的抗体序列。表达、纯化这些抗体后,进行一系列的功能验证。首先,ELISA、SPR实验证明有13株抗体结合E蛋白,亲和力相差较大 (KD=10-6~10-11M);竞争实验表明13株抗体结合在E蛋白的至少5个不同表位。其次,细胞水平的体外中和实验表明,结合其中3个表位的抗体具有高中和活性(IC50=0.17~1.87 μg/ml);动物水平(小鼠感染模型)的体内功能检测发现三个不同表位的高中和活性抗体(Z20, Z3L1和Z23)分别可以完全保护小鼠。最后,利用结构生物学手段,阐明三株保护性抗体与E蛋白的结合模式并揭示其作用机制。其中,Z20同时结合E蛋白二聚体中相邻E蛋白的DII,Z3L1主要结合E蛋白二聚体中一个E蛋白的DI以及DI与DII的连接区域,Z23主要结合DIII,同时插入到相邻两个E蛋白二聚体的沟槽中。三株抗体通过结合E蛋白的不同结构域影响膜融合过程中E蛋白构象变化从而影响病毒感染,同时Z23也有可能阻断ZIKV与受体的结合进而阻止ZIKV感染。其中,两株抗体(Z3L1和Z23)特异性阻断ZIKV感染,对于登革热等黄病毒没有交叉反应,有望进一步开发成药物,相关临床前研究正在进行并获得专利保护,为人类防治ZIKV提供了重要的抗体药物支撑。
另外中科院微生物所刘文军团队建立了快速高灵敏度逆转录环介导等温扩增寨卡病毒检测方法(Wang X, Yin F, Bi Y, et al. Rapid and sensitive detection of Zika virus by reverse transcription loop-mediated isothermal amplification.[J]. Journal of Virological Methods, 2016, 238:86-93.);中科院武汉病毒所张波研究员团队在国内一例输入性病例中分离到寨卡病毒(Deng C, Liu S, Zhang Q, et al. Isolation and characterization of Zika virus imported to China using C6/36 mosquito cells[J]. Virologica Sinica, 2016, 31(2):1-4.),建立了SYBR Green一步法实时RT-PCR检测寨卡病毒方法(Xu M Y, Liu S Q, Deng C L, et al. Detection of Zika virus by SYBR green one-step real-time RT-PCR[J]. Journal of Virological Methods, 2016, 236:93-97.);军事医学科学院秦成峰团队揭示了免疫正常小鼠感染寨卡病毒后特征(Zhang N N, Tian M, Deng Y Q, et al. Characterization of the contemporary Zika virus in immunocompetent mice.[J]. Human Vaccines & Immunotherapeutics, 2016:00-00.),2016年寨卡病毒分离株在恒河猴模型感染后临床特征(Li X F, Dong H L, Huang X Y, et al. Characterization of a 2016 Clinical Isolate of Zika Virus in Non-human Primates.[J]. Ebiomedicine, 2016, 12:170-177.),发现Adenosine Analog NITD008是一种寨卡病毒高效抑制剂(Deng Y Q, Zhang N N, Li C F, et al. Adenosine Analog NITD008 Is a Potent Inhibitor of Zika Virus.[J]. Open Forum Infectious Diseases, 2016, 3(4).),同时在寨卡病毒感染者尿液中发现病毒(Zhang F C, Li X F, Deng Y Q, et al. Excretion of infectious Zika virus in urine.[J]. Lancet Infectious Diseases, 2016, 16(6):641-642.);来自广东省疾控中心研究人员在寨卡病毒感染者泪液中检测到病毒,为寨卡病毒传播方式给出了新途径(Sun J, Wu, Zhong H, et al. Presence of Zika Virus in Conjunctival Fluid.[J]. Jama Ophthalmology, 2016, 134(11).)。
虽小编尽力将2016年我国学者在寨卡病毒研究上取得的成果纳入,由于时间匆忙,能力有限,如有遗漏,敬请谅解。欢迎在文后留言拍砖。
中国病毒学论坛是一个非盈利性的公益性论坛,致力于共建病毒学研究人员的交流互助平台。秉承“积极交流与分享,携手合作与共赢”的理念,中国病毒学论坛特创办“病毒学界”自媒体,在此向公众征稿,竭诚欢迎病毒学领域研究进展、科普文章、相关会议信息及求职招聘等各种形式投稿。
联系邮箱:china@virology.com.cn
本期编辑:Tony
| 欢迎光临 中国病毒学论坛|我们一直在坚持! (http://virology.com.cn/) |
Powered by Discuz! X3.2 |